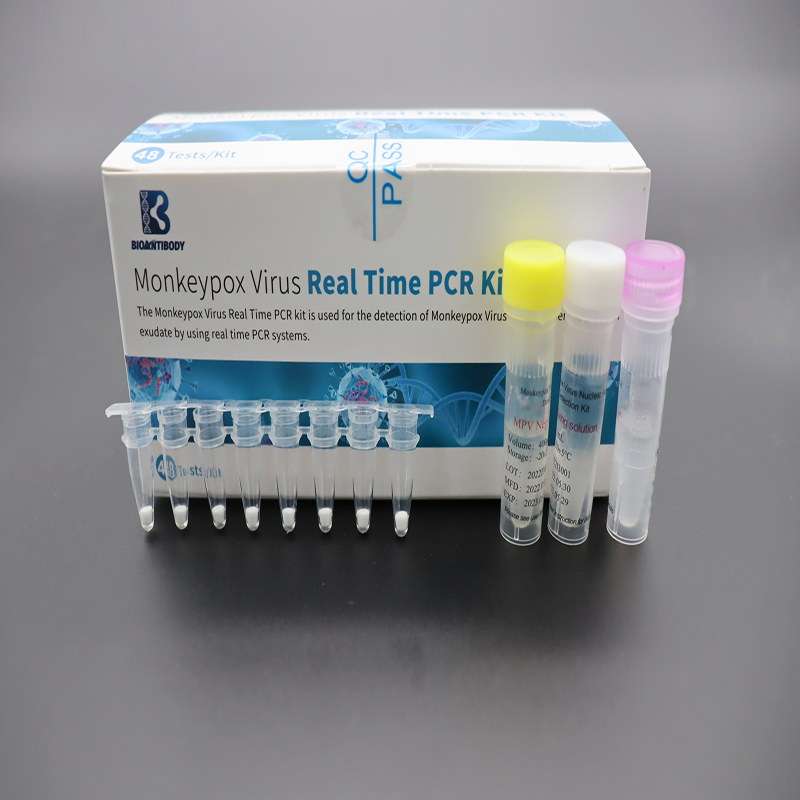
Kit PCR Waktu Nyata Virus Monkeypox
Rincian Produk
Penggunaan yang dimaksudkan
Ini digunakan untuk mendeteksi Virus Monkeypox dalam sampel serum manusia atau eksudat lesi dengan menggunakan sistem PCR waktu nyata.
Prinsip Tes
Produk ini adalah sistem uji PCR real-time Taqman® berbasis probe fluoresen.Primer dan probe khusus dirancang untuk mendeteksi gen F3L dari Virus Monkeypox.Kontrol internal yang menargetkan gen yang dilestarikan manusia memantau pengumpulan sampel, penanganan sampel, dan proses PCR waktu nyata untuk menghindari hasil negatif palsu.Kit ini merupakan sistem lyophilized premix sepenuhnya, yang mencakup bahan-bahan yang diperlukan untuk mendeteksi Virus Monkeypox: enzim amplifikasi asam nukleat, enzim UDG, buffer reaksi, primer dan probe spesifik.
Isi Utama
Komponen yang disediakan tercantum dalam tabel.
| Komponen | Kemasan | Bahan |
| Virus Cacar MonyetPremix terliofilisasi | 8 strip tabung PCR× 6 kantong | Primer, probe, Campuran dNTP/dUTP, Mg2+, Taq DNA polimerase, Enzim UDG |
| Kontrol Positif MPV | 400 μL×1 tabung | Urutan DNA yang mengandung gen Target |
| Kontrol Negatif MPV | 400 μL×1 tabung | Urutan DNA yang mengandung segmen gen manusia |
| Larutan Pelarutan | 1 mL×1 tabung | Stabilisator |
| Sertifikat Kesesuaian | 1 buah | / |
Alur Operasi
1. SampelKoleksi:Spesimen harus dikumpulkan ke dalam tabung steril sesuai
dengan spesifikasi teknis standar.
2. Persiapan Reagen (Area Persiapan Reagen)
Keluarkan komponen kit, seimbangkan pada suhu kamar untuk penggunaan siaga.
3. Pengolahan Spesimen (Area Pengolahan Spesimen)
3.1 ekstraksi asam nukleat
Disarankan untuk mengambil sampel cairan 200μL, Kontrol Positif dan Kontrol Negatif untuk ekstraksi asam nukleat, sesuai dengan persyaratan dan prosedur yang sesuai dari kit ekstraksi DNA virus.
3.2 Pelarutan bubuk terliofilisasi dan penambahan templat
Siapkan premix Lyophilized Virus Monkeypox sesuai jumlah sampel.Satu sampel memerlukan satu tabung PCR yang berisi bubuk premix terliofilisasi.Kontrol negatif & kontrol positif harus diperlakukan sebagai dua sampel.
(1) Tambahkan 15μL Larutan Pelarutan ke dalam setiap tabung PCR yang mengandung premix Lyophilized, kemudian tambahkan 5μL sampel yang diekstraksi/Kontrol Negatif/Kontrol Positif ke dalam masing-masing tabung PCR.
(2) Tutup rapat tabung PCR, jentikkan tabung PCR dengan tangan sampai bubuk terliofilisasi benar-benar larut dan tercampur, kumpulkan cairan ke bagian bawah tabung PCR dengan sentrifugasi kecepatan rendah seketika.
(3) Jika menggunakan instrumen PCR Real-time umum untuk deteksi, maka langsung pindahkan tabung PCR ke area amplifikasi;jika menggunakan BTK-8 untuk deteksi, maka perlu melakukan operasi berikut: pindahkan 10 μL cairan dari tabung PCR ke sumur chip reaksi BTK-8.Satu tabung PCR sama dengan satu lubang pada chip.Selama pengoperasian pemipetan, pastikan pipet berada pada posisi vertikal 90 derajat.Ujung pipet penghalang aerosol harus ditempatkan di tengah sumur dengan kekuatan sedang dan berhenti mendorong pipet saat mencapai gigi pertama (untuk menghindari gelembung).Setelah sumur terisi, keluarkan membran chip reaksi untuk menutupi semua sumur dan chip tersebut kemudian dipindahkan ke area deteksi amplifikasi.
4. Amplifikasi PCR (Area Deteksi)
4.1 Masukkan tabung PCR/chip reaksi ke dalam tangki reaksi dan atur nama setiap lubang reaksi sesuai urutannya.
4.2 Pengaturan pendeteksian fluoresensi: (1) virus Monkeypox (FAM);(2) Pengendalian Internal (CY5).
4.3 Jalankan protokol bersepeda berikut
Protokol ABI7500, Bio-Rad CFX96, SLAN-96S, QuantStudio:
| Langkah | Suhu | Waktu | Siklus | |
| 1 | Pra-denaturasi | 95℃ | 2 menit | 1 |
| 2 | Denaturasi | 95℃ | 10 detik | 45 |
| Annealing, ekstensi, akuisisi fluoresensi | 60℃ | 30 detik | ||
Protokol BTK-8:
| Langkah | Suhu | Waktu | Siklus | |
| 1 | Pra-denaturasi | 95℃ | 2 menit | 1 |
| 2 | Denaturasi | 95℃ | 5 detik | 45 |
| Annealing, ekstensi, akuisisi fluoresensi | 60℃ | 14 detik | ||
5. Analisis hasil (lihat Panduan Pengguna Instrumen)
Setelah reaksi, hasilnya akan disimpan secara otomatis.Klik “Analyze” untuk menganalisis, dan instrumen akan secara otomatis menginterpretasikan nilai Ct dari setiap sampel di kolom hasil.Hasil pengendalian negatif dan positif harus sesuai dengan "6. Pengendalian Mutu" berikut.
6. Kontrol kualitas
6.1 Kontrol Negatif: Tidak ada Ct atau Ct>40 di saluran FAM, Ct≤40 di saluran CY5 dengan kurva amplifikasi normal.
6.2 Kontrol Positif: Ct≤35 di saluran FAM dengan kurva amplifikasi normal, Ct≤40 di saluran CY5 dengan kurva amplifikasi normal.
6.3 Hasilnya valid jika seluruh kriteria di atas terpenuhi.Jika tidak, hasilnya tidak valid.
Interpretasi Hasil
Hasil berikut mungkin terjadi:
| Nilai Ct saluran FAM | Nilai Ct saluran CY5 | Penafsiran | |
| 1# | Tidak ada Ct atau Ct>40 | ≤40 | Virus cacar monyet negatif |
| 2# | ≤40 | Hasil apa pun | Positif virus cacar monyet |
| 3# | 40~45 | ≤40 | Tes ulang;jika masih 40~45, laporkan sebagai 1# |
| 4# | Tidak ada Ct atau Ct>40 | Tidak ada Ct atau Ct>40 | Tidak sah |
CATATAN: Jika terjadi hasil yang tidak valid, sampel perlu dikumpulkan dan diuji kembali.
informasi pemesanan
| Nama Produk | Kucing.TIDAK | Ukuran | Contoh | Umur Simpan | Trans.& Sto.Suhu. |
| Kit PCR Waktu Nyata Virus Monkeypox | B001P-01 | 48 tes/kit | Serum/ Lesi Eksudat | 12 bulan | -25~-15℃ |